在解计算题中常用到的恒等:原子恒等、离子恒等、电子恒等、电荷恒等、电量恒等,用到的方法有:质量守恒、差量法、归一法、极限法、关系法、十字交法和估算法。(非氧化还原反应:原子守恒、电荷 平衡、物料平衡用得多,氧化还原反应:电子守恒用得多)
晶体的熔点:原子晶体 >离子晶体 >分子晶体 中学学到的原子晶体有:Si、SiC 、SiO2=和金刚石。原子晶体的熔点的比较是以原子半径为依据的: 金刚石 > SiC > Si (因为原子半径:Si> C> O).

离子是否共存:
(1)是否有沉淀生成、气体放出;
(2)是否有弱电解质生成;
(3)是否发生氧化还原反应;
(4)是否生成络离子[Fe(SCN)2、Fe(SCN)3、Ag(NH3)+、[Cu(NH3)4]2+ 等];
(5)是否发生双水解。
熔点较低的金属是Hg (-38.9C。),;熔点较高的是W(钨3410c);密度较小(常见)的是K;密度较大(常见)是Pt。
能发生银镜反应的有:醛、甲酸、甲酸盐、甲酰铵(HCNH2O)、葡萄溏、果糖、麦芽糖,均可发生银镜反应。(也可同Cu(OH)2反应) 计算时的关系式一般为:—CHO —— 2Ag
注意:当银氨溶液足量时,甲醛的氧化特殊:HCHO —— 4Ag ↓ + H2CO3
反应式为:HCHO+4[Ag(NH3)2]OH = (NH4)2CO3 + 4Ag↓ + 6NH3 ↑+ 2H2O
生铁的含C量在:2%——4.3% 钢的含C量在:0.03%——2% 。粗盐:是NaCl中含有MgCl2和 CaCl2,因为MgCl2吸水,所以粗盐易潮解。浓HNO3在空气中形成白雾。固体NaOH在空气中易吸水形成溶液。
气体溶解度:在的压强和温度下,1体积水里达到饱和状态时气体的体积。
人体含水约占人体质量的2/3。地面淡水总量不到总水量的1%。当今世界三大矿物燃料是:煤、石油、天然气。石油主要含C、H地元素。
地壳中:含量较多的金属元素是— Al 含量较多的非金属元素是—O HClO4(高氯酸)—是较强的酸
氨水(乙醇溶液一样)的密度小于1,浓度越大,密度越小,硫酸的密度大于1,浓度越大,密度越大,98%的浓硫酸的密度为:1.84g/cm3。
在惰性电极上,各种离子的放电顺序:
阴极(夺电子的能力):Au3+ >Ag+>Hg2+ >Cu2+ >Pb2+ >Fa2+ >Zn2+ >H+>Al3+>Mg2+ >Na+ >Ca2+ >K+
阳极(失电子的能力):S2- >I- >Br– >Cl- >OH- >含氧酸根
注意:若用金属作阳极,电解时阳极本身发生氧化还原反应(Pt、Au除外)
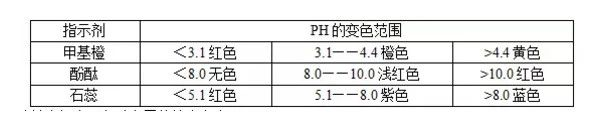
常用酸、碱指示剂的变色范围:
常见的胶体:液溶胶:Fe(OH)3、AgI、牛奶、豆浆、粥等;气溶胶:雾、云、烟等;固溶胶:有色玻璃、烟水晶等。
有机鉴别时,注意用到水和溴水这二种物质。
可使溴水褪色的物质如下,但褪色的原因各自不同:烯、炔等不饱和烃(加成褪色)、苯酚(取代褪色)、乙醇、醛、甲酸、草酸、葡萄糖等(发生氧化褪色)、有机溶剂[CCl4、氯仿、溴苯、CS2(密度大于水),烃、苯、苯的同系物、酯(密度小于水)]发生了萃取而褪色。
- 热门课程
- 热门资讯
- 热门资料
- 热门福利
-
 出版专业大学学什么?有什么就业方向?在信息时代的今天,出版产业作为信息传播的重要载体,扮演着至关重要的角色。而随着数字化技术的发展,出版行业也在不断演进,对从业者的要求也越来越高。那么,出版专业的大学生应该学些什么?未来又有哪些就业方向呢?出版专业大学学什么?1. 出版理论与实务:学生需要系统地学习出版的基本理论,包括出版流程、出版规
出版专业大学学什么?有什么就业方向?在信息时代的今天,出版产业作为信息传播的重要载体,扮演着至关重要的角色。而随着数字化技术的发展,出版行业也在不断演进,对从业者的要求也越来越高。那么,出版专业的大学生应该学些什么?未来又有哪些就业方向呢?出版专业大学学什么?1. 出版理论与实务:学生需要系统地学习出版的基本理论,包括出版流程、出版规 -
 孩子上大专一定不要报这些专业,否则就是害了孩子一生在孩子选择大学专业的时候,家长们总是格外操心,希望能为孩子选择一个有前途、有保障的专业,以便孩子将来有一个稳定的职业和生活。然而,并不是所有专业都能保证就业前景,有些专业即使完成学业,也很难找到一份称心如意的工作。在选择大专专业时,有三个专业尤其需要谨慎,那就是大数据专业、金融学专业以及律师专业。大
孩子上大专一定不要报这些专业,否则就是害了孩子一生在孩子选择大学专业的时候,家长们总是格外操心,希望能为孩子选择一个有前途、有保障的专业,以便孩子将来有一个稳定的职业和生活。然而,并不是所有专业都能保证就业前景,有些专业即使完成学业,也很难找到一份称心如意的工作。在选择大专专业时,有三个专业尤其需要谨慎,那就是大数据专业、金融学专业以及律师专业。大 -
 杭州高一英语拔高班哪里有?一对一怎么收费?高三复习时,很多孩子或许会遇到英语成绩停滞不前的瓶颈期。这可能是因为复习方法不当,或是缺乏有效的学习策略。解决这个问题的关键在于找到适合自己的学习方式,可以尝试多听、多读、多写,注重基础巩固和语境理解,同时也要保持耐心和信心,相信通过持续努力,一定能够突破瓶颈,取得更好的成绩。针对孩子遇到英语瓶颈期
杭州高一英语拔高班哪里有?一对一怎么收费?高三复习时,很多孩子或许会遇到英语成绩停滞不前的瓶颈期。这可能是因为复习方法不当,或是缺乏有效的学习策略。解决这个问题的关键在于找到适合自己的学习方式,可以尝试多听、多读、多写,注重基础巩固和语境理解,同时也要保持耐心和信心,相信通过持续努力,一定能够突破瓶颈,取得更好的成绩。针对孩子遇到英语瓶颈期 -
 在兵马俑做考古是铁饭碗吗?考古专业大学学什么?兵马俑是中国历史上的重要遗址之一,被誉为世界文化遗产。尽管已有大量的兵马俑被发掘和展示,但仍然有大量未经挖掘的区域。这意味着考古工作还需要进行很多年。挖掘这些遗址不仅可以揭示古代中国的军事制度和文化,还可以为我们提供更多关于秦朝的了解。考古学家需要花费大量时间和精力来保护、挖掘和研究这些遗址,以便将
在兵马俑做考古是铁饭碗吗?考古专业大学学什么?兵马俑是中国历史上的重要遗址之一,被誉为世界文化遗产。尽管已有大量的兵马俑被发掘和展示,但仍然有大量未经挖掘的区域。这意味着考古工作还需要进行很多年。挖掘这些遗址不仅可以揭示古代中国的军事制度和文化,还可以为我们提供更多关于秦朝的了解。考古学家需要花费大量时间和精力来保护、挖掘和研究这些遗址,以便将
-
 高考作文素材积累:流浪诗人——我的人生之路各位学生注意了,现在就要进入到2023年阴历新年,各位学生过完年距离中高考又进了一步,为方便大家能够积累更多的作文素材,小编老师为定期为大家更新优秀范文,下面大家一起来赏析“流浪诗人——我的人生之路”。 作文题 阅读下面的材料,根据要求写一篇不少于800字的文章。(60分) 黄大发,一位普
高考作文素材积累:流浪诗人——我的人生之路各位学生注意了,现在就要进入到2023年阴历新年,各位学生过完年距离中高考又进了一步,为方便大家能够积累更多的作文素材,小编老师为定期为大家更新优秀范文,下面大家一起来赏析“流浪诗人——我的人生之路”。 作文题 阅读下面的材料,根据要求写一篇不少于800字的文章。(60分) 黄大发,一位普 -
 2023年高考作文素材积累:“绝品即常品”各位学生大家觉得高考作文多少分才过关呢?小编老师觉得作文满分60分大家作文在56分以上才算是过关,大家都知道高考一分之差差之千里,大家不要放过任何一个可以提分的可能!为帮助大家积累素材,小编老师为大家整理了比较好的作文题目和作文范文,供大家参考! 作文题 阅读下面的材料,根据要求写一篇不
2023年高考作文素材积累:“绝品即常品”各位学生大家觉得高考作文多少分才过关呢?小编老师觉得作文满分60分大家作文在56分以上才算是过关,大家都知道高考一分之差差之千里,大家不要放过任何一个可以提分的可能!为帮助大家积累素材,小编老师为大家整理了比较好的作文题目和作文范文,供大家参考! 作文题 阅读下面的材料,根据要求写一篇不 -
 高考英语素材,高考英语作文开头常用句子高考英语素材,高考英语作文开头常用句子!一提到英文写作,很多同学就头疼,如何组织语言、如何下笔呢?但自从知道了一些万能的“套话”你就会发现自己的写作水平会更上一层楼!下面小编老师为大家整理了高考英语作文开头常用句子,想要了解的学生收藏起来! 开头常用句子 1.Depending on per
高考英语素材,高考英语作文开头常用句子高考英语素材,高考英语作文开头常用句子!一提到英文写作,很多同学就头疼,如何组织语言、如何下笔呢?但自从知道了一些万能的“套话”你就会发现自己的写作水平会更上一层楼!下面小编老师为大家整理了高考英语作文开头常用句子,想要了解的学生收藏起来! 开头常用句子 1.Depending on per -
 西安高三化学辅导班哪家好?化学现在在新高考的分量也比较重,很多专业都要求选择化学这门课。与物理相比化学不算难。最近有学生问老师西安高三化学辅导班哪家好?下面,小编老师为大家推荐西安一家比较好的高中补习机构,大家了解一下: 伊顿教育高三·化学辅导 基础 1.激发学习动机2.培养学习兴趣3.化学方程式总结归纳
西安高三化学辅导班哪家好?化学现在在新高考的分量也比较重,很多专业都要求选择化学这门课。与物理相比化学不算难。最近有学生问老师西安高三化学辅导班哪家好?下面,小编老师为大家推荐西安一家比较好的高中补习机构,大家了解一下: 伊顿教育高三·化学辅导 基础 1.激发学习动机2.培养学习兴趣3.化学方程式总结归纳



















